
Hace casi cien años que la científica estadounidense Barbara McClintock revolucionó la forma en la que comprendemos los genes y el ADN.
Los cromosomas, dedujo estudiando el maíz, no eran cadenas fijas y estables de información, sino que contenían trozos de ADN que saltaban de un lado al otro.
Estos “genes saltarines” o elementos transponibles, también conocidos como transposones, son fundamentales para comprender, por ejemplo, enfermedades complejas como el cáncer o ciertos trastornos degenerativos neurológicos.
Aunque fueron descritos por primera vez a finales de la década de 1920 por McClintock, la comunidad científica no supo -¿o quiso?- ver su importancia hasta décadas después, y la citogenetista recibió finalmente el Nobel de Medicina en 1983.
Ahora, un nuevo estudio llevado a cabo por científicos de la Universidad Eötvös Loránd (ELTE) de Hungría ha revelado cómo esos “genes saltarines” afectan al envejecimiento, así como los posibles métodos para frenarlo o ralentizarlo.
Cuando estos transposones se mueven demasiado, y esto ocurre más durante la vida adulta, desestabilizan el código genético, y esa puede ser una de las razones del envejecimiento, concluyen.
En qué consisten los “genes saltarines”
Los transposones son trozos del ADN que tienen la capacidad de extirparse de una zona del genoma e ir a una nueva ubicación. Estos elementos pueden hacer una copia de sí mismos para trasladarse a otras zonas del ADN.
“Pueden ir de un fragmento del ADN a otro lo que, esencialmente, también significa que pueden alterar el funcionamiento de otros genes si se insertan en una posición desafortunada”, explica a BBC Mundo Nazif Alic, profesor de Genética, Evolución y Medio Ambiente del University College de Londres (UCL).
Los genomas animales suelen tener múltiples copias de estos elementos.
“Algunos de ellos ya no tienen la capacidad de saltar. Están, de alguna forma, defectuosos. Pero los que sí que pueden hacerlo, pueden saltar y entrar en cualquier gen, por lo que, esencialmente, pueden alterar cualquier gen”, añade Alic.
Estas alteraciones son, por lo general, dañinas.
En los organismos pluricelulares existen dos tipos principales de células. Por un lado están las germinales, también conocidas como línea germinal, que son las reproductivas, las que darán lugar a los espermatozoides y los óvulos y, por lo tanto, se encargarán de pasar el material genético a los hijos.
Y por otro están las células somáticas, que son las que conforman el crecimiento de los tejidos y los órganos en los seres vivos pluricelulares.
 Los "genes saltarines" pueden extirparse de una parte del ADN e insertarse en otro lugar, provocando una alteración generalmente dañina.
Los "genes saltarines" pueden extirparse de una parte del ADN e insertarse en otro lugar, provocando una alteración generalmente dañina.Por suerte, los “genes saltarines” están prácticamente silenciados en las células germinales, por lo que estas mutaciones no se transmiten a la descendencia.
Excepcionalmente, sin embargo, algunos se pueden mover a la hora de formarse las células reproductivas, integrándose en el interior de algunos genes y alterando su expresión, lo que se conoce como una “mutación de novo”.
Esto hace que se puedan originar “algunas enfermedades como ciertos casos de hemofilias o leucemias, cánceres de colon o de mama y ciertos trastornos degenerativos neurológicos provocados por su integración en genes clave de células somáticas adultas”, escribe el biólogo Manuel Peinado Lorca, catedrático emérito de la Universidad de Alcalá de Henares, en “The Conversation”.
Cuál es su vínculo con el envejecimiento
Los investigadores Ádám Sturm y Tibor Vellai, de la Universidad Eötvös Loránd, en Hungría, han logrado establecer un vínculo entre esos transposones o “genes saltarines” y el envejecimiento. Su estudio ha sido publicado por la revista "Nature Communications".
Los científicos han identificado un proceso específico, llamado la vía Piwi-piARN, que ayuda a controlar o, de alguna forma, silenciar los transposones.
Según han podido comprobar, este proceso funciona en cierto tipo de células que no envejecen, como las células madre cancerosas, así como en un animal tan enigmático como fascinante, la conocida como “medusa inmortal” (Turritopsis dohrnii).
En su estudio, los investigadores de la universidad húngara realizaron experimentos con Caenorhabditis elegans, un tipo de gusano de aproximadamente 1mm de longitud que se usa de manera habitual en experimentos sobre envejecimiento, estudios de enfermedades relacionadas con la edad y los mecanismos de longevidad.
Al reforzar la vía Piwi-piARN en el gusano, este vivía significativamente más tiempo.
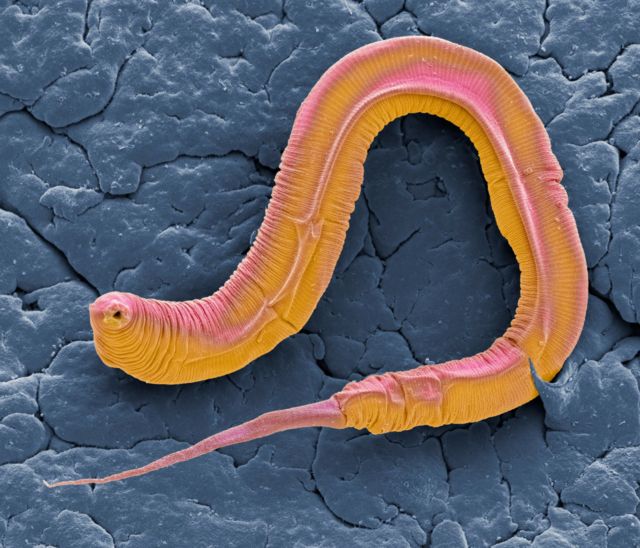
El Caenorhabditis elegans se utiliza a menudo para estudios relacionados con el envejecimiento.
Sturm y Vellai ya habían teorizado en dos estudios anteriores publicados en 2015 y 2017 sobre la relación entre ese mecanismo y el concepto de inmortalidad biológica. Ahora han logrado probarlo de manera experimental.
Los investigadores utilizaron diversas técnicas para silenciar la actividad de los genes saltarines.
Cuando lo hicieron con transposones específicos en los gusanos, los animales mostraban signos de envejecimiento más lento. Y aún más: cuando controlaban múltiples transposones a la vez, los efectos de esa prolongación de la vida útil se sumaban.
El experimento muestra una ventaja significativa en la prolongación de la vida útil, según explicó Ádám Surm, uno de los autores del estudio, y "esto abre la puerta a innumerables aplicaciones potenciales en el mundo de la medicina y la biología".
Además, el estudio encontró cambios epigenéticos (modificaciones genéticas que afectan a la actividad genética sin cambiar la secuencia del ADN) en el ADN de los gusanos a medida que envejecían, específicamente en los transposones o genes saltarines.
Analizar esos cambios, según Tibo Vellai, podría ser un método “para determinar la edad a partir del ADN, proporcionando un reloj biológico preciso".
De esta forma, al comprender mejor los “genes saltarines” y las vías que los controlan, podría servir a los científicos para encontrar nuevas formas de prolongar la vida y mejorar la salud en los años de la vejez.
“En el campo del envejecimiento, hemos sabido desde hace bastante tiempo que los transposones parecen activarse cuando los animales se hacen mayores, pero hasta ahora había pocos estudios que hubieran intentado ver si esto está directamente relacionado con el envejecimiento”, explica a BBC Mundo Nazif Alic.
Sin embargo, el simple hecho de que algo ocurra más con la edad no significa que sea eso lo que en realidad causa el envejecimiento. Podría ser simplemente un resultado del mismo envejecimiento, argumenta Alic.
Para diferenciar entre causa y una simple correlación, los investigadores hacen experimentos en los que evitan que ocurra algo determinado, para observar si eso extiende realmente la vida útil de un organismo modelo en particular.
Otros estudios habían intentado antes desactivar los genes saltarines, “pero no necesariamente lo hicieron de manera tan específica y quizás tan concluyente como lo que hizo este estudio”, explica el investigador de UCL.
La ciencia está estudiando asimismo otras vías para frenar el desgaste que se produce con la edad avanzada.
Además de promover el ejercicio físico y la nutrición saludable, que ayudan a combatirlo, hay farmacéuticas que están buscando fórmulas para matar a las células senescentes, y laboratorios que se centran en rejuvenecimiento celular mediante la reprogramación transcripcional de las células.
"Hasta donde yo sé, nada de ese trabajo ha llegado aún a la clínica, por lo que creo que todavía es un área que tiene mucho potencial", concluye Alic.














